La Cour de Justice de Union Européenne (CJUE) remet en cause les fondements de l’Arrêté du 22 août 1990, interdisant l’utilisation des feuilles et des fleurs de Chanvre. Celui-ci constitue une entrave à la libre circulation de marchandises. Cette décision aura sans aucun doute des conséquences notables pour le marché du Cannabidiol (CBD).

Avant d’entrer dans les détails de cette décision, il convient de différencier le Chanvre du Cannabis.
Chanvre et Cannabis : deux plantes distinctes
Le chanvre et le cannabis appartiennent à la même famille et au même genre, MAIS à 2 espèces différentes issues de la même plante mère. Le nom latin du chanvre est Cannabis Sativa L. tandis que celui du cannabis est Cannabis indica.
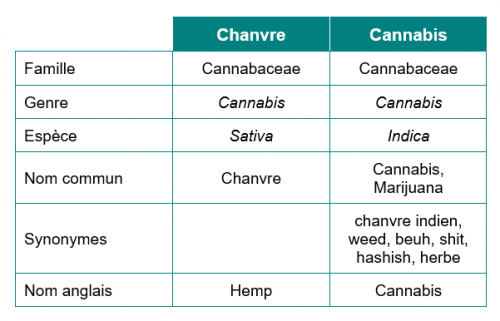
Les 2 plantes se distinguent par des caractéristiques botaniques différentes :
- le chanvre forme une tige qui peut atteindre 4 m, voire 5 m de hauteur.
- le cannabis est beaucoup plus petit à l’âge adulte. Lorsqu’il pousse, il forme un buisson avec plusieurs ramifications.
Les fibres produites sont donc très différentes.
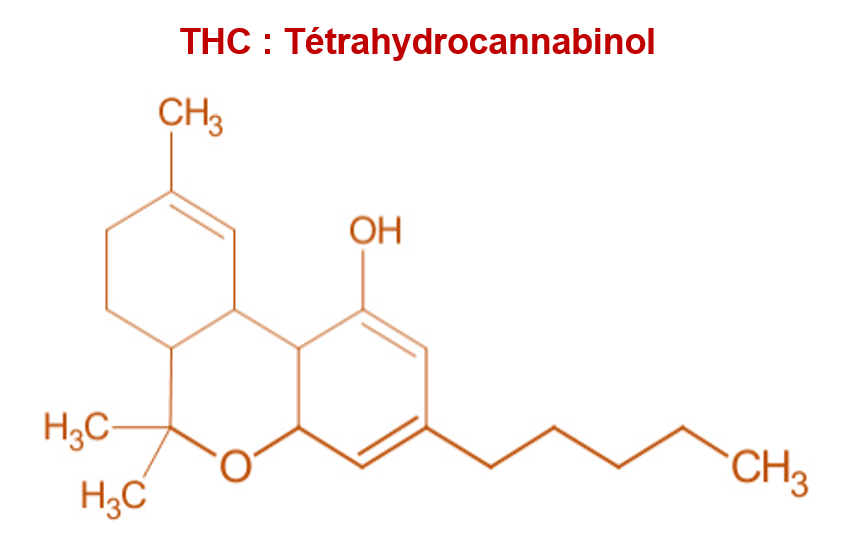
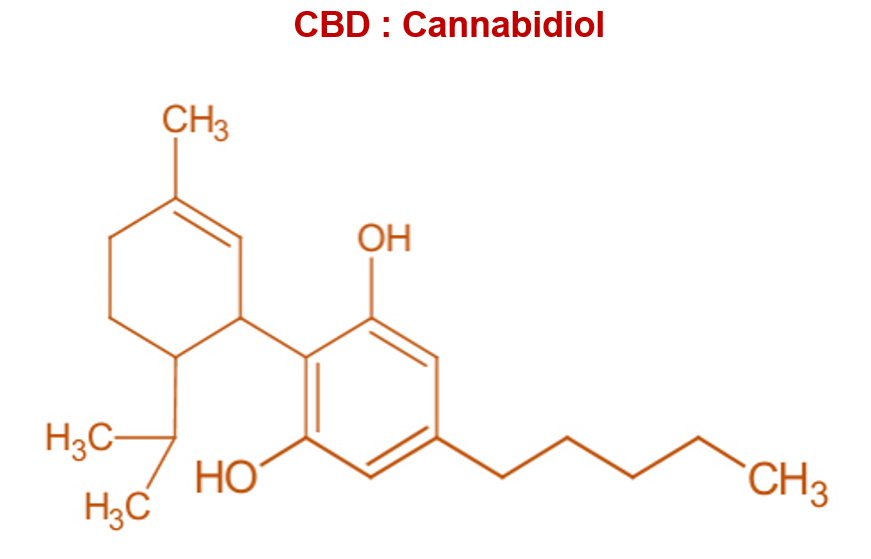
Les 2 plantes se distinguent également par leur composition, et notamment par leur teneur en cannabinoïdes. Les plantes du genre Cannabis contiendraient jusqu’à 200 cannabinoïdes différents selon certains auteurs. Les plus connus sont le THC (tétrahydrocannabinol) et le CBD (cannabidiol). Ces 2 molécules ont la même formule brute (C21H30O2), mais des formules développées différentes (voir ci-dessous).
Le cannabis est très riche en THC. Sa concentration est de 4 à 9 % dans la plante totale (en % de l’extrait sec), et peut atteindre 30 % dans la résine (le plus souvent comprise entre 10 et 20 %). Cette molécule est responsable des propriétés psychoactives du cannabis qui ont conduit à le classer dans la liste des stupéfiants (arrêté du 22 février 1990).
Le cannabis contient également, en plus faible quantité (0,1 à 2,9 % de la matière sèche) du CBD. Il est utilisé contre les convulsions, l’inflammation, l’anxiété, et le traitement des nausées et présente des propriétés sédatives.
De son côté, le chanvre est faiblement concentré en THC, et peut contenir, selon les variétés, jusqu’à 15 % de CBD.
Quelles sont les conclusions de la CJUE vis-à-vis de l’affaire C-663/18 ?
En France, l’utilisation de feuilles et de fleurs de chanvre (Cannabis Sativa L) est interdite (arrêté du 22 août 1990 portant application de l’article R. 5132-86 du code de la santé publique pour le cannabis). Seule l’utilisation des tiges et des graines est possible. Par conséquent, la commercialisation de tous produits dérivés, fabriqués à partir de feuilles ou de fleurs de chanvre, et donc de plante entière, est également interdite. C’est notamment le cas des liquides pour cigarettes électroniques contenant du cannabidiol (CBD), comme le précise la Note de service du 23 juillet 2018 (2018/F/0069/FD2) de la Direction des Affaires Criminelles et de Grâces (Ministère de la Justice).
Dans ce contexte, le Tribunal Correctionnel de Marseille a condamné, en janvier 2018, deux entrepreneurs à 15 et 18 mois de prison avec sursis et 10 000 € d’amende. Ils commercialisaient des cartouches pour cigarettes électroniques contenant du liquide élaboré à partir d’huile essentielle issue de plantes entières de Cannabis sativa L. Cette huile essentielle est légalement produite en République Tchèque.
Les accusés ont fait appel auprès de la Cour d’Appel d’Aix en Provence. Celle-ci a saisi la Cour de Justice de l’Union Européenne afin d’évaluer la conformité de la règlementation française vis-à-vis de la règlementation européenne (Arrêt n° 2018/315 – Question préjudicielle ordinaire).
Le 19 novembre dernier, la CJUE a rendu ses conclusions (Affaire C-336/18). Elles remettent en cause les fondements de l’arrêté du 22 août 1990. Selon la CJUE, l’arrêté français constitue une entrave à la libre circulation de marchandises. Son existence ne peut être justifiée par la volonté de protéger les consommateurs. En effet, cette fonction existe déjà dans la règlementation européenne qui encadre la culture et la commercialisation du chanvre, du fait de sa proximité avec le cannabis (règlements (UE) n° 1307/2013 et 1308/2013). Elle autorise uniquement les variétés « offrant des garanties en ce qui concerne la teneur en substances indésirables », c’est-à-dire les variétés contenant moins de 0,2 % de THC.
Par ailleurs, la CJUE rappelle que le CBD n’est pas une substance stupéfiante (arrêté du 22 février 1990). Il ne s’agit pas non plus d’une substance dopante (décret n° 2018-1283). En parallèle, l’ANSM a conclu, en 2015, à l’absence de données suffisantes pour classer le CBD comme nocif (Commission des stupéfiants et psychotropes – 25/06/2015). L’OMS a recommandé, en 2017, qu’il ne soit pas classé au niveau international comme substance contrôlée.
Attention cependant, l’ANSM alertait contre les dangers du CBD à la suite de la Commission des stupéfiants et psychotropes du 11 octobre 2018, qui précisait que le CBD peut induire des effets secondaires, présenter des effets psychotropes, et pourrait, in vivo, se transformer en THC sous certaines conditions.
Face à cette décision, la Mission Interministérielle de Lutte contre les drogues et les conduites addictives a publié, sur son site internet, la position des autorités françaises vis-à-vis de cette décision européenne (article publié le 24 novembre 2020). Les Autorités françaises prennent note de cette décision. Elles insistent cependant sur les potentiels effets nocifs du CBD. En outre, elles militent auprès de la Commission européenne pour qu’une législation commune soit établie au sein de l’Union Européenne afin d’encadrer la commercialisation de produits contenant du CBD, sous des formes très variées.
L’usage du chanvre est-il possible en alimentation ?

Les graines de chanvre sont autorisées en alimentation humaine (Registre novel food), du fait de leur historique en termes de consommation (Règlement (UE) n° 2015/2283) – voir article sur les Novel Food.
Elles présentent de nombreux atouts nutritionnels. Elles sont riches en protéines (20 à 25 % de la graine entière, 33 % pour la graine décortiquée) contenant tous les acides aminés essentiels en quantités équilibrés. Elles contiennent par ailleurs des fibres, et possèdent un profil en acides gras essentiels intéressant : l’huile contient 14 à 18 % d’oméga 3, de 55 à 57 % d’oméga 6. (Bouloc P. et al. 2006 ; Callaway J.C. 2010).
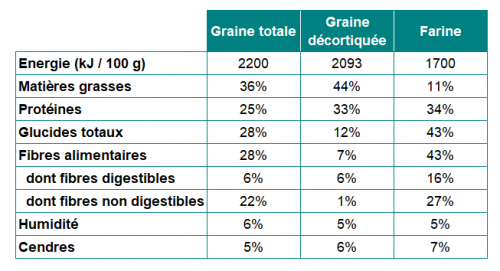
Les graines sont utilisées en l’état ou après transformation (farines et farines dégraissées, huiles, protéines issues de tourteaux, desserts et boissons, préparations fermentées, …).
Le registre novel food spécifie néanmoins qu’il existe des règlementations spécifiques dans les Etats Membres. Par ailleurs, la création de nouveaux ingrédients peut conduire à la modification des caractéristiques du chanvre (par exemple une extraction différenciante). Aussi il convient de se renseigner auprès des Autorités avant la mise sur le marché de toutes les nouvelles formes alimentaires ou de tous nouveaux ingrédients issus de graines de chanvre.
Les graines de chanvre sont donc autorisées dans les compléments alimentaires. A noter cependant que Cannabis sativa L. est absent de la liste des plantes françaises (arrêté du 24 juillet 2014 établissant la liste des plantes autorisées dans les compléments alimentaires en France), mais présent dans la Liste BelFrIt (Liste commune établie par la France, l’Italie et la Belgique) du fait de son inscription dans le décret Italien (decreto 10 agosto 2018).
Les extraits de CBD issus du chanvre (ou de toutes autres plantes) sont pour leur part considérés comme des novel food au sein de l’Union Européenne (Registre novel food). Il en est de même pour tous les cannabinoïdes (naturels ou de synthèse), ainsi que des aliments enrichis en CBD. Leur commercialisation est donc interdite dans l’Union Européenne en l’absence d’une demande d’autorisation construite selon les modalités du règlement novel food (règlement (UE) n° 2015/2283). Et pourtant, depuis le 1° janvier 2019, 145 notifications ont été signalées sur le portail RASFF (Rapid Alert System for Food and Feed) de l’Union Européenne. Cela signifie donc que plusieurs denrées alimentaires (aliments courants ou compléments alimentaires) sont commercialisées illégalement en Europe. Plusieurs demandes d’autorisation ont été établies par différents opérateurs. Elles sont actuellement en cours d’évaluation par l’EFSA. La décision de la CJUE dans le cadre de l’Affaire C-663/18 aura peut-être un impact sur ces demandes. L’avenir nous le dira !
Quid du Cannabis thérapeutique en France ?
Le cannabis thérapeutique est autorisé dans de nombreux pays. Voici une liste non-exhaustive des pays à l’avoir autorisé ces dernières années : Autriche, Allemagne, Belgique, Croatie, Danemark, Espagne, Finlande, France, Grèce, Irlande, Italie, Luxembourg, Pays-Bas, Pologne, Portugal, République Tchèque, Roumanie, Royaume-Uni, Slovaquie, Slovénie et Suède) et de 12 pays hors UE (Australie, Suisse, Liechtenstein, Norvège, Canada, Nouvelle-Zélande, Israël, Chili, Uruguay, Colombie, Mexique, Argentine, Pérou, Koweït Suisse, plusieurs Etats des Etats-Unis…
En France, nous nous posons tout juste la question de sa légalisation. En effet, le 10 septembre 2018, l’ANSM a créé un CSST (Comité Scientifique Spécialisé Temporaire) présidé par le Professeur Nicolas Authier dans le but d’évaluer la pertinence de l’utilisation du cannabis à des fins thérapeutiques en France. Les conclusions de ce comité ont été rapportées auprès du Sénat le 29 mai 2019 : l’autorisation du cannabis à visé thérapeutique est considérée comme pertinente dans certaines situations cliniques (voir tableau ci-contre).
Le CSST a remis à l’ANSM son rapport final le 27 juin 2019. Celui-ci avait pour but de définir le cadre de l’expérimentation et ses modalités de mise en œuvre (prescripteurs autorisés, circuits de distribution et de délivrance, modalités d’administration et formes pharmaceutiques, dosages et concentrations en principes actifs dispensés).

L’expérimentation devait être initiée dans le courant du 2° semestre 2019. Cependant, le calendrier a pris du retard. En effet, le décret relatif à l’expérimentation du cannabis médical a été publié le 7 octobre dernier (décret n° 2020-1230). L’essai devrait donc commencer avant mars 2021 pour une durée de 2 ans. Il portera sur 3000 patients. Ces derniers seront suivis selon les modalités décrites par l’arrêté du 29 octobre 2020. Les caractéristiques des médicaments testés seront prochainement définies dans un arrêté spécifique. Néanmoins, le site de l’ANSES précise les points suivants :
- médicaments à base de fleurs séchées de cannabis et d’extraits à spectre complet
- formes à effet :
- immédiat : mise à disposition de formes sublinguales et inhalées (huile et fleurs séchées pour vaporisation …)
- prolongé : mise à disposition de formes orales (solution buvable et capsules d’huile…).
- 5 ratios THC/CBD :
- THC 1 : 1 CBD,
- THC 1 : 20 CBD,
- THC 1 : 50 CBD,
- THC 5 : 20 CBD,
- THC 20 : 1 CBD.
Vers un usage récréatif du cannabis ?
L’ensemble de ces évolutions pourraient laisser penser que l’usage récréatif du cannabis serait prochainement légalisé en Europe, à l’image des nombreuses légalisations ou dépénalisations actées ces dernières années dans différents pays. Cependant, cette mesure ne sera probablement pas adoptée à court et moyen termes, voire à long terme, tant à l’échelle de la France qu’à celle de l’Union Européenne.
Vous souhaitez des précisions sur ce sujet ?


