Le 26 novembre dernier, le Règlement d’exécution (UE) n° 2020/1772 a été publié. Il modifie le Règlement d’exécution (UE) n° 2017/2469 dont le but était d’établir les règles administratives et scientifiques applicables aux demandes d’autorisation des Novel Food. Nous profitons ainsi de cette publication pour vous apporter un éclairage sur le concept des Novel Food.

Qu’est-ce qu’un novel food ?
Selon le Règlement (UE) 2015/2283, un aliment ou un ingrédient est un novel food si sa consommation est restée négligeable dans l’Union Européenne avant le 15 mai 1997 (date de publication du 1° Règlement novel food). Tous les nouveaux aliments ou ingrédients issus de différentes matières premières sont donc concernés :
- micro-organismes, champignons, algues, ou matières premières isolées ou produites à partir de ces organismes,
- matériaux d’origine minérale,
- végétaux ou de parties de végétaux et les substances isolées ou produites à partir de ces derniers,
- animaux ou parties d’animaux et les substances isolées ou produites à partir de ces derniers,
- nanomatériaux,
- vitamines, minéraux et autres substances (nouvelles formes d’apports),
- cultures cellulaires ou tissulaires dérivées d’animaux, de végétaux, de micro-organismes, de champignons ou d’algues, ou les substances isolées ou produites à partir de ces organismes.
Les aliments ou ingrédients utilisés exclusivement dans des compléments alimentaires au sein de l’Union Européenne avant le 15 mai 1997, sont également concernés, lorsqu’on souhaite étendre leur utilisation aux aliments courants.
Les nouveaux procédés (non utilisés avant 1997) sont aussi concernés dans la mesure où ils peuvent impacter la composition de la matière première, sa structure moléculaire, ses valeurs nutritionnelles, son métabolisme ou sa teneur en substances indésirables. Il s’agit par exemple des nouveaux procédés utiliser pour transformer ou de traiter les aliments : technologies d’extraction, de purification, de débactérisation… Cela concerne aussi les méthodes de multiplication végétale et de reproduction animale.
NB : le règlement novel food ne concerne pas les OGM, les enzymes, les additifs, les arômes ou les solvants d’extraction. Ils dépendent en effet de textes spécifiques.
Et concrètement, avez-vous des exemples ?
Parmi les différents novel food autorisés, nous pouvons citer la pulpe du pain de singe (fruit du baobab), le DHA extrait de microalgues, les graines de chia, le lycopène issu de la tomate, l’extrait de romarin utilisé comme antioxydant, les protéines de colza, les protéines de pomme de terre, le physalis, les stérols végétaux, la lactoferrine bovine, le jus de noni, l’huile de krill…
Le tableau ci-dessous recapitule les derniers novel food autorisés depuis le début de l’année 2020.
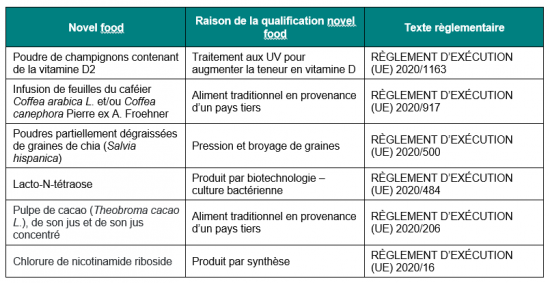
Comment savoir si un aliment ou un ingrédient est novel food ?
Tous les novel food autorisés sont inscrits dans la Liste de l’Union, établie à la suite de la publication du Règlement d’exécution (UE) n° 2017/2740. Cette Liste de l’Union, aussi désignée sous le terme « Registre novel food », est accessible en ligne.
Lorsqu’un nouvel aliment est autorisé, un projet de Règlement d’exécution est rédigé par la Commission Européenne et soumis au Comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux (Scopaff – Standing Committee on Plants, Animals, Food and Feed). La Liste de l’Union est alors implémentée en conséquence. Elle contient ainsi l’ensemble des informations relatives au novel food autorisé : origine variétale, process de fabrication, caractérisation, restrictions d’usages éventuelles.
Quelle est la procédure d’autorisation des novels food ?
Les aliments et ingrédients novel food ne peuvent pas être commercialisés si leur innocuité n’est pas établie. Ainsi, pour pouvoir commercialiser un novel food, il est nécessaire de faire une demande auprès de la Commission européenne.
Il existe 2 modalités distinctes pour ces demandes, en fonction de l’origine du novel food :
- Dans le cas où le novel food est un aliment traditionnel, en provenance d’un pays tiers, et pour lequel il est possible d’établir un historique d’utilisation sûre pendant plus de 25 ans dans ce pays tiers, la demande est faite selon une procédure simplifiée (articles 14 à 20 du Règlement (UE) n° 2015/2283). Le pétitionnaire établit une demande qu’il soumet à la Commission européenne. Cette demande est transmise à l’EFSA et aux Etats Membres pour évaluation.
- En l’absence d’objection, la commercialisation du novel food est autorisée. La Liste de l’Union est mise à jour. Les conclusions des autorités peuvent être obtenues sous 6 mois.
- Lorsqu’une objection est émise par l’EFSA ou l’un des Etats Membres, le pétitionnaire peut établir un dossier de demande complémentaire transmis à la Commission Européenne. Après évaluation de la demande, l’EFSA publie un avis. Si les conclusions sont positives, la Commission Européenne rédige un projet d’acte d’exécution autorisant la mise sur le marché du novel food qu’elle transmet au Comité. La procédure est alors allongée d’un minimum de 10 mois.
- Pour les autres novel food, la demande est faite auprès de la Commission européenne, selon la procédure globale (articles 10 à 12 du Règlement (UE) n° 2015-2283). Elle doit être argumentée d’un dossier technico-scientifique, contenant notamment la caractérisation du novel food, ses modalités de production, ainsi que les résultats d’études toxicologiques, allergènes… La Commission européenne communique alors la demande à l’EFSA pour avis. La procédure totale prend au minimum 17 mois, mais est en général beaucoup plus longue.
Des lignes directrices ont été établies par l’EFSA pour orienter les opérateurs dans la constitution des dossiers de demandes d’autorisation. Celles-ci sont disponibles sur le site de l’EFSA (https://www.efsa.europa.eu/fr/topics/topic/novel-food).
Les demandes doivent être réalisées sur la plateforme du site Europa (e-soumission).
Point important : lorsque le novel food est le fruit de travaux de recherches, il est possible de protéger certaines données pendant une durée de 5 ans, en précisant leur caractère confidentiel lors de la demande d’autorisation.
Un système de surveillance de tous les novel food autorisés
Tous les novel food autorisés sont soumis à un système de surveillance mis en place dans chaque pays de l’Union Européenne. En France, celui-ci est intégré au système de Nutrivigilance initié par le décret n° 2010-688 (Articles R1323-1 à R1323-4 du code de la santé publique et Article L221-1-3 du Code de la consommation). Ce système, géré par l’ANSES, a pour but de surveiller les effets indésirables observés pour les novel food, mais aussi pour les compléments alimentaires, les aliments infantiles, les substituts de ration totale pour le contrôle du poids, les DADFMS et les aliments enrichis.
Vous souhaitez connaître le statut novel food d’un ingrédient ou d’un aliment ?
Vous voulez déposer une demande auprès de la Commission Européenne ?
Contactez-moi : je saurais vous orienter !



tres bonne definition